Clique na imagem para acessar o arquivo
Neste Blog realizamos: 1 - Atualização sobre SAÚDE PÚBLICA, PESQUISA BIOMÉDICA E BIOSSEGURANÇA. 2 - Atualização sobre a ocorrência de Doenças de importância em animais de laboratório e outras espécies. 3 - Troca de Informações sobre Doenças Infecciosas, Zoonoses, Licenciamento Ambiental, Defesa Sanitária Animal, Vigilância Sanitária, Boas Práticas de Laboratório e demais assuntos relacionados à sanidade e Saúde Pública.
Pesquisar Neste Blog
quinta-feira, 18 de novembro de 2010
INSTITUTO OSWALDO CRUZ - CURSOS DE VERÃO
Postado por
SHDA_CECAL FIOCRUZ
às
10:23
0
comentários


Enviar por e-mailPostar no blog!Compartilhar no XCompartilhar no FacebookCompartilhar com o Pinterest
Marcadores:
Cursos - IOC
Videoconferência discute diagnóstico e tratamento adequados da dengue
Profissionais de saúde de todo o país poderão participar gratuitamente, pela internet ou em salas de videoconferência
O Canal Saúde transmite amanhã, quinta-feira (18), das 14 às 16h, uma videoconferência sobre atendimento, diagnóstico e tratamento adequados de pacientes com suspeita de dengue. Profissionais de saúde de todo o Brasil poderão assistir gratuitamente à videoconferência, que está marcada para as 14h e tem duração prevista de duas horas. A palestra Aspectos do Manejo Clínico no paciente com Dengue será conduzida pelo infectologista Rivaldo Venâncio da Cunha, da Universidade Federal do Mato Grosso do Sul, e transmitida para todo o Brasil, a partir da sala da Rede Nacional de Ensino e Pesquisa (RNP), em Brasília.
Entre os assuntos que serão abordados pelo infectologista estão os sintomas que podem levantar a suspeita da doença, testes de confirmação necessários, sinais de alarme (indicativos de que a doença pode evoluir para formas mais graves) e a conduta médica adequada para cada caso, conforme o quadro do paciente. Também será debatido o tratamento da dengue em grupos específicos de pacientes, como idosos, menores de 15 anos, gestantes e pessoas com doenças pré-existentes. O palestrante Rivaldo Venâncio da Cunha é também pesquisador da FIOCRUZ.
A videoconferência será transmitida ao vivo através do site do Canal Saúde. Para assistir, basta acessar –www.canalsaude.fiocruz.br.
Mais informações:
Canal Saúde/Fundação Oswaldo Cruz – Assessoria de Comunicação Social
Ana Cristina Figueira e Adriana Nunes
(21) 3194-7700 / 3194-7704
Postado por
SHDA_CECAL FIOCRUZ
às
10:20
0
comentários


Enviar por e-mailPostar no blog!Compartilhar no XCompartilhar no FacebookCompartilhar com o Pinterest
EUA conduzem primeiro teste em humanos de vacina contra malária
Cientistas do Exército americano estão conduzindo os primeiros testes em seres humanos de uma vacina para a forma mais comum de malária, causada pelo protozoário Plasmodium vivax. A vacina, desenvolvida no Instituto de Pesquisa Walter Reed do Exército americano, nas proximidades de Washington, consiste em uma proteína que estimula o sistema imunológico do organismo, ativando suas defesas naturais contra a doença, uma das mais mortíferas do mundo.
" Até hoje não foi possível encontrar uma vacina para a doença por causa da capacidade do parasita de se modificar rapidamente para se adaptar aos hospedeiros humanos. "
Vinte e oito voluntários receberam doses da vacina por meses e, no início de novembro, foram infectados pelo mosquito transmissor da doença. Os cientistas acreditam que em uma semana poderão avaliar se o teste foi um sucesso.
Até hoje não foi possível encontrar uma vacina para a doença por causa da capacidade do parasita de se modificar rapidamente para se adaptar aos hospedeiros humanos.
Motivação
Os voluntários recebem alguns milhares de dólares para participar dos testes, mas muitos dizem que a motivação principal é ajudar no desenvolvimento da ciência.
- Meu pai era médico e sempre soube que, para avançar, a ciência necessita de testes em humanos - disse uma das voluntárias, a médica Mengee Shan. - Sendo uma pessoa da ciência, sentia que precisaria repensar minha carreira se não pudesse me dedicar a algo como isto, especialmente se pretendo pedir para que outros participem em meus projetos médicos - completa.
Essa forma de malária infecta cerca de 300 milhões de pessoas anualmente.
Outra variante da malária, a Plamodium falciparum, endêmica na África, é mais mortal, mas menos comum.
Mosquitos
Para o teste, os voluntários foram picados por mosquitos com malária trazidos da Tailândia. Cerca de 10 dias após as picadas, alguns começaram a apresentar sintomas da doença.
"Começou com uma dor de cabeça, depois um mal estar generalizado durante o dia. Passei a sentir dor em meus globos oculares e a ter uma grande sensibilidade para o frio ou o calor. Eu suava e tinha calafrios à noite. Era como uma gripe muito forte", disse o médico do Exército americano Joseph Civitello.
Ele faz parte de outro grupo de voluntários. Estes não receberam a vacina, mas foram picados pelos mosquitos para garantir que todos os participantes do estudo fossem infectados.
Contrair de propósito uma das doenças mais letais do mundo foi "sem dúvida, uma loucura", diz ele.
- Foi estranho porque sabia que ficaria doente. Felizmente estou em um quarto de hotel com médicos e enfermeiros próximos e não em alguma missão ao ar livre - afirma.
Os voluntários são monitorados 24 horas por dia em um hotel no Estado de Maryland, próximo de Washington. Os cientistas dizem que levará outra semana ainda antes que possam dizer se o teste foi um sucesso ou fracasso. A vacina pode ser completamente eficiente em alguns casos ou oferecer proteção parcial em outros.
De qualquer modo, os resultados devem ser usados para o aprimoramento de vacinas no futuro.
Postado por
SHDA_CECAL FIOCRUZ
às
07:33
0
comentários


Enviar por e-mailPostar no blog!Compartilhar no XCompartilhar no FacebookCompartilhar com o Pinterest
Marcadores:
Vacina Malária
Biblioteca oferece treinamento em bases de dados 'Dynamed', 'Gideon' e 'Medline with full text' na Ensp, dia 19/11
A Biblioteca de Saúde Pública, do Instituto de Comunicação e Informação Científica e Tecnológica em Saúde (Icict/Fiocruz), convida docentes, pesquisadores, bolsistas, estagiários, bibliotecários, profissionais de informação e alunos de pós-graduação da Fiocruz para o treinamento em três importantes bases de dados da empresa EBSCO. São elas: Dynamed, Gideon e Medline with full text. O treinamento tem como objetivo fornecer uma visão sistemática das bases de dados bibliográficas e respectivos mecanismos de busca. O treinamento ocorre no dia 19/11, no Salão Internacional da Ensp, e será ministrado pelos representantes da EBSCO.
Informações básicas sobre as bases de dados:
• DynaMed - plataforma de atualização profissional que responde a praticamente as questões clínicas durante a prática médica totalmente baseadas em evidências.
• GIDEON (Global Infectious Disease and Epidemiology Network) - é a base de dados sobre que oferece informação atualizada baseada em evidência médica a respeito do diagnóstico, tratamento e aprendizado nas áreas de doenças tropicais e infecciosas, epidemiologia e microbiologia de todos os países.
• Medline with full text - é a mais abrangente fonte de periódicos de medicina em texto completo do mundo, provendo artigos na íntegra de aproximadamente 4.800 periódicos indexados na MEDLINE. Destes, mais 1.450 possuem também texto completo para muitos dos periódicos mais utilizados na MEDLINE, inclusive o The New England Journal of Medicine. Possui ainda mais de 1.400.000 artigos em texto completo retroativos a 1965.
Serviço:
Data: 19/11/2010 das 9h às 13h
Local: Salão Internacional da Ensp
Rua Leopoldo Bulhões, 1480 - Prédio da Ensp – 4º andar
Postado por
SHDA_CECAL FIOCRUZ
às
07:32
0
comentários


Enviar por e-mailPostar no blog!Compartilhar no XCompartilhar no FacebookCompartilhar com o Pinterest
Good news for 'good' cholesterol
Positive results inject life into strategy to treat heart disease.
A strategy for lowering heart-disease risk that once seemed to be a dead end is showing fresh promise. Decades of animal studies and epidemiological data had suggested that raising blood levels of high-density lipoprotein — HDL, or 'good' cholesterol — might have a stronger protective effect against heart disease than statins, drugs that lower levels of low-density lipoprotein ('bad' cholesterol or LDL). But in 2006, a US$1-billion trial of torcetrapib, an HDL-raising drug, found it seemed to increase patients' risk of death, casting a pall of doubt over the entire field. This week, the first study since to focus on the class of drugs that boosts HDL levels may offer good news for the approach.
The study, published in The New England Journal of Medicine1, was a 1,623-patient trial investigating the safety of anacetrapib, a drug functionally similar to torcetrapib, developed by pharmaceutials giant Merck, based in Whitehouse Station, New Jersey. The drug inhibits a protein called CETP, which raises HDL. The trial found with 94% confidence that anacetrapib does not harm patients — in contrast to the 15,000-patient trial of torcetrapib, also a CETP inhibitor. When Pfizer halted that trial early2, many companies stopped working on CETP blockers. Researchers were left wondering whether torcetrapib's failure was down to unexpectedly high toxicity in that compound, whether the inhibition of CETP itself is harmful, or whether the idea that raising HDL levels lowers risk is flawed.
The anacetrapib trial also tracked the drug's effects on LDL and HDL levels, which, according to Christopher Cannon, a cardiovascular researcher at Brigham and Women's Hospital in Boston, Massachusetts, and the study's principal investigator, are "jawdropping". After 24 weeks on the drug, patients experienced a 138% increase in HDL levels. In contrast, exercising and changing diet might only raise HDL by 10%, says Cannon. The participants, all of whom were also on statins, experienced a further 40% reduction in LDL levels.
Although the study wasn't large enough to look at the effect of anacetrapib on heart disease, the researchers noted some positive trends: 3.3% of patients taking the drug experienced heart attacks, stroke or other kinds of cardiovascular events, compared with 5.3% of patients in the placebo group.
The drug's apparent safety is encouraging, says Prediman Shah, director of cardiology and atherosclerosis research at Cedars-Sinai Medical Center in Los Angeles, California, "but there are some interesting red flags". One, he says, has to do with c-reactive protein (CRP), a marker of inflammation in blood that tends to drop as patients regulate their cholesterol with statins or lifestyle changes. Despite the huge changes in LDL and HDL levels, CRP levels actually increased slightly.
ADVERTISEMENT
Shah also says he is surprised that such enormous shifts in HDL levels yielded such small clinical benefits. "In all fairness, the study wasn't powered to test that," says Shah, but if epidemiological predictions on HDL's benefits are correct, the drug should virtually "confer immortality".
Whether raising HDL really works won't become clear until data from larger studies begin to emerge, Shah says. An international, 30,000-patient trial testing anacetrapib's efficacy will begin next year, but results won't come in until at least 2014 (see Table 1). Meanwhile, results on another CETP inhibitor called dalcetrapib, developed by Roche, are expected in 2013.
References
- Cannon, C. P. et al. N. Engl. J. Med. doi:10.1056/NEJMoa1009744(2010).
- Pearson, H. Nature 444, 794-795 (2006).
Postado por
SHDA_CECAL FIOCRUZ
às
06:59
0
comentários


Enviar por e-mailPostar no blog!Compartilhar no XCompartilhar no FacebookCompartilhar com o Pinterest
Marcadores:
Colesterol bom
Disease-in-a-dish approach gives clues to Rett syndrome
Unregulated jumping genes are a possible culprit for the debilitating disease.
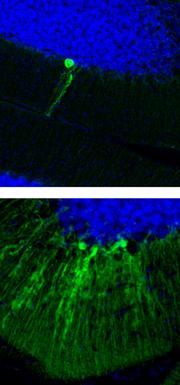
A 'disease in a dish' experiment, in which skin cells from sufferers of the neurodevelopmental disorder Rett syndrome were made to develop into neurons, has provided insight into what goes wrong in the brains of people with the condition. The result marks a crucial step towards clinical applications for a technique that is seen as a smoking hot field.
The approach involves reprogramming cells from people with a particular disorder into an embryonic state known as induced pluripotent stem cells (iPS cells). The cells are then differentiated into types of tissue that are affected by the condition. iPS cells were first created from human tissue in 2007, and since then scientists have been racing to build libraries of patient cell lines in the hope that the disease-in-a-dish technique will allow them to study the mechanisms of different conditions.
"You can't just take blood or skin. You need to look at the tissue where [the disease mechanism] is happening," says Fred Gage, a geneticist at the Salk Institute for Biological Studies in La Jolla, California.
Gage and his colleagues applied the approach to Rett syndrome, a rare disorder that causes children to develop increasing problems with movement, coordination and communication. Researchers have known for more than a decade1 that the syndrome can be caused by a mutation in a gene called MECP2, which encodes the protein MeCP2. Their latest study, published today in Nature2, finally offers clues as to how such mutations lead to disease.
Beyond mouse models
The team examined the role of MeCP2 in mice, and found that knocking out the gene in neurons leads to increased activity of a type of 'jumping gene' called an L1 retrotransposon. These sequences of DNA can detach themselves from the genome, replicate, and reinsert themselves elsewhere. In their latest study, Gage and his colleagues showed that neurons derived from iPs cells from people with Rett syndrome showed more L1 activity than did healthy controls, just as in the MeCP2-deficient mouse models. The researchers checked their results in brain tissues taken from patients after they died.
“You can't just take blood or skin. You need to look at the tissue where the disease mechanism is happening.”
Gage's past experiments have shown that such jumping genes are naturally active in the brain, leading to speculation that they may play a role in generating diversity among neurons3, however, this activity is tightly controlled. The altered L1 activity in Rett neurons suggests a possible role in the disease, perhaps in creating too little or too much diversity, say the researchers.
The same team provided further evidence of differences between Rett and healthy neurons in a paper published last week in Cell4. That study, also based on the disease-in-a-dish approach, showed that neurons derived from people with Rett syndrome had, among other differences, considerably fewer synapses than did healthy controls.
The two threads of evidence "provide one of those 'mmmm' experiences, and make you start to really think about what goes wrong in kids with Rett syndrome," says Evan Snyder, a stem-cell biologist at the Burnham Institute for Medical Research in La Jolla.
However, he points out that the connections between L1 activity, MeCP2 and the disease, although impressive, are still just associations. Demonstrating just where cells go awry during development is not simple. "We are still at the validation stage," says Snyder.
A jump forwards
Gage admits that his experiments raise more questions than they answer. Are elevated L1-activity levels and reduced numbers of synapses causally related? Can either be said to cause the symptoms of Rett syndrome? "There is no direct evidence on either yet," says Gage.
ADVERTISEMENT
But Gage's colleague Alysson Muotri, a neuroscientist at the University of California, San Diego, is a little bolder, citing a 2005 study by the team that showed that some neuronal genes are targeted by L1 insertions3. "To me, this is clear evidence that L1s can impact the genome of neuronal cells," he says. The team will now take a closer look at the effect of manipulating L1 levels in mouse models and in human neurons.
Despite lingering questions, Gage and his team's successful study is likely to accelerate competition among researchers working with the disease-in-a-dish approach. Snyder, for example, has a library of some 50 lines of iPS cells, covering Alzheimer's disease, spinal muscular atrophy, bipolar disorder and other conditions, which he is also probing for causal mechanisms of disease.
But challenges remain. The current technology is so labour intensive that a key goal of the approach, using the cells to test drug candidates, is impossible for now. "It is not viable to take this to a drug company," says Gage. Conditions such as schizophrenia or autism, for which there is no clearly related gene, will also be difficult to study using the technique.
References
Postado por
SHDA_CECAL FIOCRUZ
às
06:50
0
comentários


Enviar por e-mailPostar no blog!Compartilhar no XCompartilhar no FacebookCompartilhar com o Pinterest
Marcadores:
Síndrome de Rett
Assinar:
Comentários (Atom)


