 |
As baterias do coração totalmente artificial precisam ser constantemente carregadas, e é preciso ter baterias extras disponíveis. |
| Síndrome de Marfan |
Troy Golden, um pastor nascido no Estado americano de Oklahoma, nasceu com um coração previsto para falhar a qualquer momento. Ele sofre de uma condição conhecida como Síndrome de Marfan, que afeta todo o seu corpo, inclusive o seu coração e suas válvulas.
Em setembro do ano passado, Golden se tornou uma das poucas pessoas nos Estados Unidos a ter seu coração inteiramente substituído por um mecanismo chamado Coração Totalmente Artificial.
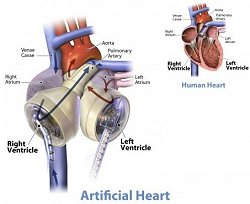
É um dispositivo feito de plástico que pesa 160 gramas e é maior que um coração biológico. Sua energia é gerada por uma bomba pneumática que você pode carregar em uma mochila.
Transplante
Doenças cardíacas ameaçam a vida de milhões, mas, como há poucos corações disponíveis para transplantes, a medicina vem buscando a forma definitiva de reparar ou substituir esse órgão vital.
Aos 41 anos, Golden já tivera que se submeter a uma cirurgia para salvar sua vida, substituindo válvulas e remodelando as paredes de seu coração. Mas sua condição continuou a piorar. Em janeiro de 2010, ele foi incluído na lista de transplantes de coração, mas o prazo se esgotou sem que ele encontrasse um doador.
"O coração de Troy era tão ruim que uma bomba tradicional não seria o suficiente," explica o cardiologista de Golden, o médico Doug Horstmanshof. "Então, nós decidimos fazer algo completamente diferente, substituindo o coração."
coração totalmente artificial
O autor da cirurgia de implante, James Long, se recorda do momento em que o coração foi implantado em Golden. "O medo era grande. E era assustador olhar dentro do peito e saber que a única coisa que ainda ainda o mantinha vivo era a bomba sintética que usamos para substituir o seu coração.
Golden teve de se acostumar ao som ininterrupto da bomba pneumática. Mas ele conta estar se sentindo muito bem. "É incrível poder sair do hospital e ser capaz de voltar para casa e retomar a vida normal", afirma Golden.
"Você não consegue nem entender como se pode tirar o coração, sem o qual você não está vivo", comenta.
O Coração Totalmente Artificial deu a Golden sua vida de volta e o fez ter esperança.
Mas essa não é uma solução permanente. As baterias de seu coração precisam ser constantemente carregadas, e é preciso ter baterias extras disponíveis. O risco de sofrer uma infecção ou coágulo eram preocupações adicionais.
Por enquanto, Golden precisa retomar a longa espera pela doação de um coração, mas para outras pessoas com corações defeituosos há soluções possíveis. As novas possibilidades na área de pesquisa estão se centrando em formas de auxiliar o coração em vez de em formas de substituí-lo.
 |
| O coração totalmente artificial depende de equipamentos e baterias que o paciente carrega na mochila. |
Bombas cardíacas
Cada vez mais, pacientes que sofrem de falhas cardíacas estão sendo implantados com bombas em miniatura, usadas para auxiliar as funções cardíacas. Eles são do tamanho de um charuto e, de um modo geral, são ligados à principal câmera de bombeamento do coração, para auxiliar o órgão.
Ao contrário do coração artificial de Golden, estes podem ser mantidos no lugar indefinidamente. Mas talvez o mais notável seja o fato de que essas bombas possam ser removidas, assim que o coração estiver recuperado.
E algumas das pesquisas mais promissoras realizadas atualmente tem a ver com o potencial de recuperação de corações, após estes terem sido danificados.
Há um forte interesse em pesquisas envolvendo células-tronco, porque elas têm a capacidade de, nas condições certas, se transformarem em um grande número de diferentes tipos de células com funções especializadas. Por isso, elas podem participar do processo de renovação e de substituição de tecidos danificados.
Os resultados preliminares ainda são altamente polêmicos, mas há crescentes indícios de que no futuro seremos capazes de aprimorar a capacidade de regeneração do coração.
Novos corações
Uma terapia mais radical vem sendo desenvolvida por Doris Taylor, da Universidade de Minnesota, que usa células-tronco para de fato construir novos corações em seu laboratório.
Ela já realizou um experimento com um rato, que consistiu em retirar as células cardíacas e implantar no órgão células-tronco que se adaptam ao tecido cardíaco, o que faz com que o coração volte a bater.
"A ideia seria pegar um coração, por exemplo, de um porco, retirar todas as células, encaixar células de um paciente para desenvolver o suficiente delas para criar um coração que se encaixe em seu corpo e transplantá-lo", afirma Taylor.