 |
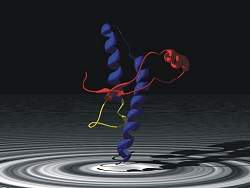
| Modelo de um príon, uma Partículas Proteica Infecciosa. |
Simplicidade perigosa
Cientistas do Instituto de Pesquisas Scripps (EUA) identificaram um agregado de proteínas - um príon - capaz de causar a morte de neurônios de um modo semelhante ao visto no "mal da vaca louca".
A diferença é que o príon agora descoberto, extremamente simples em sua estrutura, é pelo menos 10 vezes mais letal que espécies maiores de príons.
Príon é uma sigla em inglês para o termo Partículas Proteicas Infecciosas.
Esta molécula tóxica única agora descoberta - ela é um monômero - desafia o conceito aceito pela ciência de que o dano neuronal está associado à toxicidade de agregados priônicos - que são oligômeros.
Alfa-helicoidal
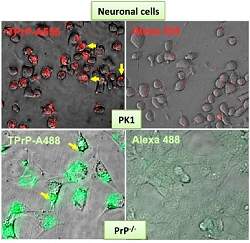
Nas experiências, a nova forma tóxica de proteína anormal, chamada de TPrP, causou vários tipos de danos neuronais.
Esses danos vão da apoptose (a morte celular programada) até a autofagia e o "canibalismo" de componentes celulares, assim como assinaturas moleculares muito semelhantes às observadas nos cérebros de animais infectados com príons.
O estudo descobriu que a forma mais tóxica do príon tem uma estrutura específica, conhecida como alfa-helicoidal.
 |
| O príon agora descoberto, extremamente simples em sua estrutura, é pelo menos 10 vezes mais letal que espécies maiores de príons. |
Novos caminhos para explorar
"Ao identificar uma única molécula como a espécie mais tóxica de príon [que se conhece], abrimos um novo capítulo na compreensão de como ocorre a neurodegeneração induzida por príons," disse Corinne Lasmézas, que liderou o estudo.
Além das informações que oferece sobre doenças causadas por príons, como o "mal da vaca louca" e uma forma humana rara da doença de Creutzfeldt-Jakob, o estudo abre a possibilidade de que proteínas neurotóxicas similares possam estar envolvidas em doenças neurodegenerativas, como Alzheimer e Parkinson.
Nas doenças causadas por príons, acredita-se que os príons infecciosos têm a capacidade de se reproduzir, mesmo sendo compostos unicamente de proteínas e não terem DNA e nem RNA.
Proteína príon celular
As células dos mamíferos normalmente produzem o que é conhecido como "proteína príon celular" ou PrP.
Durante a infecção com uma doença priônica, a proteína anormal - ou incorretamente dobrada - converte o príon normal do hospedeiro para a sua forma patológica.
Lasmézas explica que as doenças de príons são semelhantes à doença de Alzheimer e outras doenças causadas pelo dobramento incorreto de proteínas na medida que são causadas pela toxicidade de uma proteína do hospedeiro que se dobrou incorretamente.
Trabalhos recentes também descobriram que doenças como o Alzheimer lembram as doenças de príon ao se difundir de célula para célula.
Monômeros
O novo estudo acrescenta um outro complicador.
"Até agora, pensava-se que as proteínas tóxicas em todas essas doenças fossem oligômeros," diz Lasmézas. "Como agora descobrimos que um monômero anormalmente dobrado é altamente tóxico, abre-se a possibilidade de que isso possa ser verdade também para outras doenças envolvendo dobramento incorreto de proteínas."
O estudo foi publicado esta semana na edição online da revista Proceedings of National Academy of Sciences.