 |
| A descoberta, que pode tornar mais eficiente o diagnóstico e o tratamento de leucemias, representa uma mudança no conceito médico que até então considerava esse tipo de célula como, necessariamente, tumoral. |
Todas as pessoas com mais de 70 anos de idade têm no organismo células idênticas às células de um tipo de câncer, denominado Leucemia Linfocítica Crônica (LLC).
A descoberta, que pode tornar mais eficiente o diagnóstico e o tratamento de leucemias, representa uma mudança no conceito médico que até então considerava esse tipo de célula como, necessariamente, tumoral.
A conclusão é fruto de três anos de um trabalho coordenado pelo hematologista Alberto Orfao, do Centro de Investigação de Câncer da Universidade de Salamanca, na Espanha, com a colaboração do professor Carlos Eduardo Pedreira, da Coppe/UFRJ.
O estudo, que associa medicina e engenharia, já resultou em um artigo publicado na edição de abril de Leukemia, publicação especializada em leucemias da prestigiosa revista científica Nature.
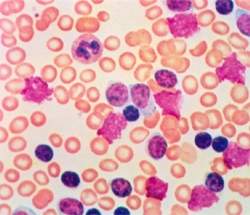
Célula de leucemia em indivíduos sadios
O objetivo da pesquisa, que envolveu a participação de 639 doadores voluntários, era entender e quantificar a presença desse tipo de célula leucêmica em indivíduos sadios com mais de 40 anos.
O professor Alberto Orfao conta que o resultado - a presença das células tidas como tumorais em 100% das amostras colhidas em pessoas com 70 anos ou mais - surpreendeu a própria equipe.
"A expectativa era de que o percentual ficasse próximo ao obtido por especialistas em trabalhos anteriores, que apontavam para a ocorrência de células leucêmicas em apenas 5% dos casos analisados".
Exame matemático
O estudo trouxe outra contribuição ao mostrar que, para identificar a presença de células da Leucemia Linfocítica Crônica (LLC) no organismo, é necessário coletar, no mínimo, 50ml de sangue. Com menos do que isso não é possível detectar as células.
"Isso explica a significativa diferença de percentual obtida nos resultados de pesquisas anteriores. Como há poucas células tipo LLC no organismo saudável, uma amostra com menos de 50 ml de sangue não contém o número mínimo suficiente para que sejam detectadas pelos exames laboratoriais", explica o professor da Coppe.
Foi ele quem elaborou os modelos matemáticos utilizados na pesquisa e que, entre outras coisas, permitiram estimar a quantidade mínima de sangue necessária para as análises.
Para o professor Alberto Orfao, a descoberta é um primeiro passo para o entendimento da doença. "Antes, células cancerígenas eram tratadas como necessariamente tumorais. Nosso trabalho mostrou que, na verdade, elas podem ser células normais" - explica.
Segundo o professor da Universidade de Salamanca, as próximas etapas da pesquisa buscarão entender melhor como a doença se desenvolve no organismo, possibilitando no futuro a descoberta de fármacos mais eficientes no combate à doença.
Leucemia
A leucemia é um tipo de câncer que afeta os glóbulos brancos ou leucócitos, células que defendem o organismo contra a ação de microorganismos. Esse tipo de câncer altera o material genético existente no núcleo das células, desregulando as funções que elas desempenham.
Quando a anomalia genética afeta o ciclo de vida celular, há um acúmulo indesejado de células não-funcionais no organismo e, a isso, dá-se o nome de câncer. Quando os atingidos são os leucócitos do sangue, esse câncer é chamado de leucemia.
A alteração do DNA no núcleo dos leucócitos pode mudar a vida celular de duas maneiras: a primeira é fazendo com que os glóbulos brancos se reproduzam de maneira desordenada, e a segunda é cancelando a apoptose, a chamada "morte programada" das células.
No primeiro caso, conhecido como leucemia aguda, as células leucêmicas se espalham com velocidade pelo organismo, a doença se agrava rapidamente e pode se instalar também na medula óssea.
No segundo caso, o acúmulo de células é lento, já que, ao invés da produção excessiva, há apenas uma não-mortalidade.A doença é então chamada de leucemia crônica, ou seja, tem evolução lenta.
As leucemias são subdivididas de acordo com o tipo de célula cancerígena. A leucemia linfocítica crônica é, quase exclusivamente, uma doença que se manifesta em pessoas mais velhas e ataca um tipo específico de leucócitos chamados de linfócitos.
Dificilmente essa doença causa problemas muito graves à saúde ou atinge pessoas com menos de 40 ou 50 anos. O tratamento é mais brando e, geralmente, visa apenas a controlar o acúmulo de células alteradas.
Segundo dados do site do Instituto Nacional do Câncer (Inca), em 2010 foram registrados 9.580 novos casos de pessoas com leucemia, sendo 5.240 homens e 4.340 mulheres. Ao todo, entre homens e mulheres, a taxa de morte ficou em pouco mais de 5 mil vítimas (2008).
Matemática a serviço da vida
A pesquisa, que analisou amostras sanguíneas de moradores da região de Castilla Leon, no nordeste da Espanha, contou com a participação de 11 pesquisadores da Universidade de Salamanca e de integrantes da rede hospitalar local.
Os médicos parceiros pediram o consentimento de alguns pacientes para colher as amostras de sangue que foram utilizadas no estudo. Os mais de 600 voluntários foram selecionados de acordo com critérios físicos e geográficos, de modo que representassem a população do lugar.
Dos 11 pesquisadores envolvidos na pesquisa liderada por Alberto Orfao, o professor de Engenharia Elétrica da Coppe, Carlos Eduardo Pedreira, era o único não-médico. Os programas de análise e previsão que ele desenvolveu permitiram à equipe de Orfao trabalhar com os dados colhidos.
Os programas desenvolvidos pelo professor da Coppe tornaram possível trabalhar com dados estatísticos em um ambiente simulado de experimentação. Para garantir a confiabilidade das informações, os modelos matemáticos calculavam uma projeção de resultados dentro de uma determinada margem de erro. Como explica o professor Pedreira, esse cálculo funciona como se "o mesmo experimento fosse repetido várias e várias vezes, estabelecendo um limite de confiança entre o melhor e o pior caso". A esse procedimento estatístico, dá-se o nome de "intervalo de confiança".
A aplicação dessa técnica nos dados colhidos dos mais de 600 pacientes permitiu estimar a projeção do número de casos em que a célula cancerígena do tipo LLC estará presente no organismo saudável. As informações foram divididas entre três faixas etárias: dos 40 aos 59 anos, dos 60 aos 69 e de 70 anos em diante. Quanto maior a faixa etária, maior a quantidade de casos que apresentaram células cancerígenas: 18% no primeiro grupo, 36% no segundo e 100% no grupo de doadores com 70 anos ou mais. Os modelos matemáticos também estimaram a quantidade mínima de sangue necessário para indicar a presença de células cancerígenas no organismo: 50 ml.
A fim de confirmar os resultados encontrados nas projeções, nove pacientes que se enquadravam na terceira faixa de idade - a partir dos 70 anos - foram convidados a voltar a doar, desta vez 50 ml de sangue. A segunda análise comprovou as predições: oito destes indivíduos, embora permanecessem saudáveis, apresentavam células tipo LLC no organismo.